
En la tabla periódica se
encuentran
agrupados los
elementos que
tiene
propiedades
químicas y físicas
semejantes.
Los elementos de la tabla periódica se dividen en 3 grupos:
METALES
Son buenos conductores del calor y la electricidad, se dividen en la tabla periódica en 6 grupos:
Alcalinos, se caracterizan por tener un solo electrón en su orbital más externa(s).
Alcalinotérreos,son un grupo de elementos que se
encuentran situados en el Grupo 2 (IIA) de la tabla periódica.
Lantánidos, son 15 elementos que van
desde Lantano hasta Lutecio.
Actínidos, van desde el Actinio hasta
el Laurencio.
Metales de transición, son aquellos situados
en la parte central del sistema periódico, en el bloque d, ya que en todos
ellos su orbital d está ocupado por electrones en mayor o menor medida.
Metales del bloque p, se denominan así
porque pertenecen al Bloque p de la Tabla Periódica, lo cual indica que sus
electrones de valencia están en los orbitales p de su nivel energético más
externo.
METALOIDES
Exhiben un comportamiento intermedio entre los elementos
metálicos y no metálicos, en lo que a asuntos de ionización y propiedades de
enlace se refiere. Es decir, son elementos que actúan como Metales en algunas situaciones, y como No
Metales en otras.
NO METALES
Entre los no metales se encuentran los elementos que no son buenos
conductores de electricidad ni de calor, tenemos los Halógenos, se pueden combinar
con los metales para formar Halogenuros.
Los gases nobles, estos elementos son los únicos con su octeto de
electrones completo.
PROPIEDADES PERIODICAS DE LOS ELEMENTOS
La naturaleza periódica de un elemento químico es una
característica del elemento, que cambia según su posición en la tabla periódica
de los elementos, esto quiere decir que depende de su número atómico y sirve
para definir el tamaño de un átomo.
ELECTRONEGATIVIDAD
Indica la habilidad de un átomo para atraer y sostener electrones para formsr un enlace quimico. La electronegatividad se mide con la escala de Paulin que va desde 0.7 a 4.
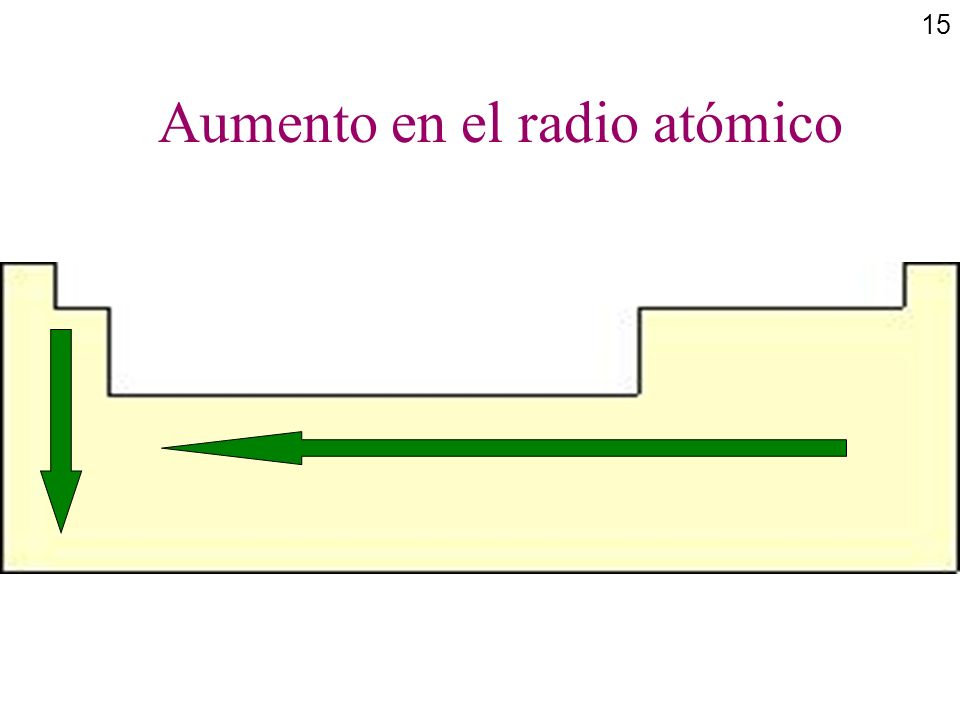
RADIO ÁTOMICO
basicamente es medir la distancia entre el nucleo de un átomo y la nube de electrones que componen su capa externa. El radio atomico aumenta de arriba hacia abajo y de izquierda a derecha.
AFINIDAD ELECTRONICA
La afinidad electrónica se basa en la medición de la energía
liberada por un átomo en estado fundamental y no en estado gaseoso al recibir
un electrón.
Además, es la energía mínima necesaria para la liberación de un electrón perteneciente
a un anión de un determinado elemento
ENERGIA DE IONIZACIÓN
El potencial de ionización mide lo inverso a la afinidad
electrónica, por lo tanto, podemos decir que mida la energía necesaria para
retirar un electrón de un átomo neutro en estado fundamental.
Considerando que la energía necesaria para retirar el primer
electrón siempre es mayor que la necesaria para retirar el segundo electro que
a su vez es menor que la tercera y así sucesivamente.

CARÁCTER METALICO
Se refiere a si tiene carácter de metal o no metal. Aumenta
de arriba hacia abajo y de izquierda a derecha.

Referencias
Licenciada Nereida Marroqín, (2020). Quimica General l.











Buena organización de la información, me gusta como va el trabajo, quedo a la espera de las otras unidades
ResponderBorrar